La tendinopatia è accompagnata da una cascata di eventi infiammatori che promuovono la degenerazione tendinea. Tra le varie citochine, l'interleuchina-1β svolge un ruolo centrale nel guidare i processi catabolici, con conseguente attivazione delle metalloproteinasi della matrice e una ridotta sintesi del collagene, che promuovono entrambi la degradazione della matrice extracellulare del tendine. La terapia con campo elettromagnetico pulsato (PEMF) viene spesso utilizzata per la gestione del dolore, l'artrosi e la guarigione ritardata delle ferite. È stato dimostrato che il trattamento in vitro con PEMF delle cellule derivate da tendine modula le citochine pro-infiammatorie, limitando potenzialmente i loro effetti catabolici.
Tuttavia, la nostra comprensione dei meccanismi cellulari e molecolari sottostanti rimane limitata. Abbiamo quindi studiato le risposte a livello di trascrittoma di costrutti simili a tendini 3D derivati dalle cellule del tendine di Achille di ratto innescato da Il-1β al trattamento con PEMF ad alta energia.
L'analisi RNASeq e l'assegnazione dell'ontologia genica hanno rivelato che vari processi biologici sono influenzati dal PEMF, compreso il rimodellamento della matrice extracellulare e la regolazione negativa dell'apoptosi. Inoltre, mostriamo che i membri della famiglia citoprotettiva Il-6/gp130 e il recettore esca Il-1β Il1r2 sono regolati positivamente sull'esposizione a PEMF.
In conclusione, i nostri risultati forniscono una visione meccanicistica fondamentale sulla modalità d'azione cellulare e molecolare del PEMF sulle cellule tendinee e possono aiutare a ottimizzare i protocolli di trattamento per la terapia non invasiva delle tendinopatie.
L'analisi RNASeq e l'assegnazione dell'ontologia genica hanno rivelato che vari processi biologici sono influenzati dal PEMF, compreso il rimodellamento della matrice extracellulare e la regolazione negativa dell'apoptosi.
Inoltre, mostriamo che i membri della famiglia citoprotettiva Il-6/gp130 e il recettore esca Il-1β Il1r2 sono regolati positivamente sull'esposizione a PEMF.
In conclusione, i nostri risultati forniscono una visione meccanicistica fondamentale sulla modalità d'azione cellulare e molecolare del PEMF sulle cellule tendinee e possono aiutare a ottimizzare i protocolli di trattamento per la terapia non invasiva delle tendinopatie.
Renate Gehwolf 1 2,
Bettina Schwemberger 3 4,
Malik Jessen 5 6 7,
Stefanie Korntner 8,
Andrea Wagner 9 10,
Christine Lehner 11 12,
Nadja Weissenbacher 13 14,
Herbert Tempfer 15 16,
Andrea Traweger 17 18 Affiliazioni
- 1Institute of Tendon and Bone Regeneration, Paracelsus Medical University-Centro per le lesioni del midollo spinale e la rigenerazione dei tessuti Salisburgo, 5020 Salisburgo, Austria. renate.gehwolf@pmu.ac.at.
- 2Cluster austriaco per la rigenerazione dei tessuti, 1200 Vienna, Austria. renate.gehwolf@pmu.ac.at.
- 3Institute of Tendon and Bone Regeneration, Paracelsus Medical University-Centro per le lesioni del midollo spinale e la rigenerazione dei tessuti Salisburgo, 5020 Salisburgo, Austria. b.schwemberger@pmu.ac.at.
- 4Cluster austriaco per la rigenerazione dei tessuti, 1200 Vienna, Austria. b.schwemberger@pmu.ac.at.
- 5Institute of Tendon and Bone Regeneration, Paracelsus Medical University-Centro per le lesioni del midollo spinale e la rigenerazione dei tessuti Salisburgo, 5020 Salisburgo, Austria. m.jessen@stud.uni-heidelberg.de.
- 6Cluster austriaco per la rigenerazione dei tessuti, 1200 Vienna, Austria. m.jessen@stud.uni-heidelberg.de.
- 7Istituto di Medicina Trasfusionale e Immunologia, Facoltà di Medicina di Mannheim, Servizio donatori di sangue della Croce Rossa tedesca Baden-Württemberg-Hessen gGmbH, Università di Heidelberg, 68167 Mannheim, Germania. m.jessen@stud.uni-heidelberg.de.
- 8Laboratorio di ingegneria rigenerativa, modulare e dello sviluppo (REMODEL); Science Foundation Ireland Center for Research in Medical Devices (CÚRAM) National University of Ireland Galway; H91 W2TY Galway, Irlanda. stefanie.korntner@nuigalway.ie.
- 9Institute of Tendon and Bone Regeneration, Paracelsus Medical University-Centro per le lesioni del midollo spinale e la rigenerazione dei tessuti Salisburgo, 5020 Salisburgo, Austria. andrea.wagner@pmu.ac.at.
- 10Cluster austriaco per la rigenerazione dei tessuti, 1200 Vienna, Austria. andrea.wagner@pmu.ac.at.
- 11Institute of Tendon and Bone Regeneration, Paracelsus Medical University-Centro per le lesioni del midollo spinale e la rigenerazione dei tessuti Salisburgo, 5020 Salisburgo, Austria. christine.lehner@pmu.ac.at.
- 12Cluster austriaco per la rigenerazione dei tessuti, 1200 Vienna, Austria. christine.lehner@pmu.ac.at.
- 13Institute of Tendon and Bone Regeneration, Paracelsus Medical University-Centro per le lesioni del midollo spinale e la rigenerazione dei tessuti Salisburgo, 5020 Salisburgo, Austria. nadja.weissenbacher@pmu.ac.at.
- 14Cluster austriaco per la rigenerazione dei tessuti, 1200 Vienna, Austria. nadja.weissenbacher@pmu.ac.at.
- 15Institute of Tendon and Bone Regeneration, Paracelsus Medical University-Centro per le lesioni del midollo spinale e la rigenerazione dei tessuti Salisburgo, 5020 Salisburgo, Austria. herbert.tempfer@pmu.ac.at.
- 16Cluster austriaco per la rigenerazione dei tessuti, 1200 Vienna, Austria. herbert.tempfer@pmu.ac.at.
- 17Institute of Tendon and Bone Regeneration, Paracelsus Medical University-Centro per le lesioni del midollo spinale e la rigenerazione dei tessuti Salisburgo, 5020 Salisburgo, Austria. andreas.traweger@pmu.ac.at.
- 18Cluster austriaco per la rigenerazione dei tessuti, 1200 Vienna, Austria. andreas.traweger@pmu.ac.at.
Figure 1 Experimental setup for high energy pulsed electromagnetic field (PEMF/rPMS) treatment of tendon-like constructs. (
A) Tendon derived stem progenitor cells were isolated from 3 months old female F344 rats (
n = 3) and used for the generation of 3D tendon-like constructs. Four different treatment groups were established: an untreated control group, a +Il-1β treated group, a +PEMF treatment group and a +PEMF+Il-1β treatment group. After PEMF treatment regimen total RNA of the 4 treatment groups was isolated for RNASeq analysis. (
B) Image of tendon-like constructs after 7 days of contraction. (
C) Position of tendon-like constructs in PEMF coil during treatment.
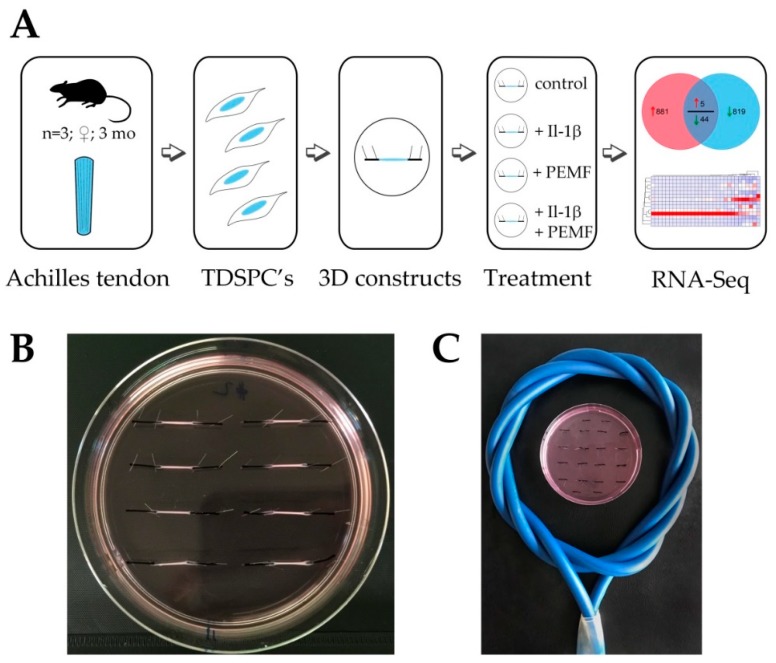 Figure 2
Figure 2 Cell viability and cellular metabolic activity of treated tendon-like constructs (
A) Live/Dead Assay showing viable cells in green and dead cells in red. (
B) Total cellular ATP content after +Il-1β and +PEMF+Il-1β treatment is significantly diminished compared to untreated control or +PEMF treatment alone. (
C) MTT Assay was performed for determination of metabolic activity of TDSPCs, showing a significant decrease in metabolic activity in the +Il-1β and +PEMF+Il-1β treatment groups. **
p < 0.01, ***
p < 0.001.
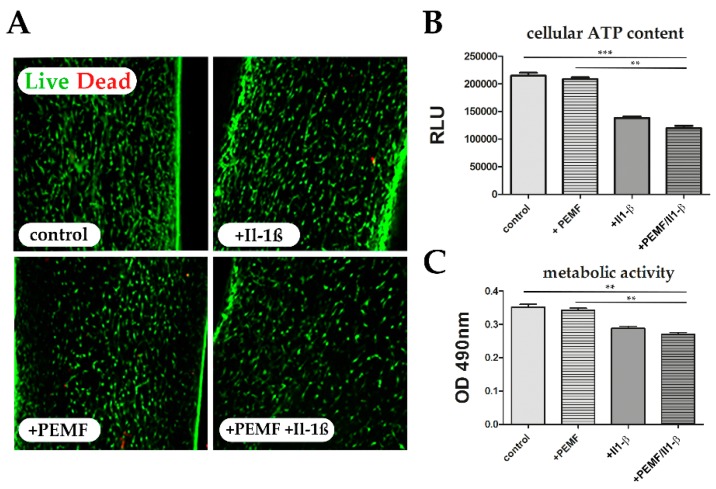 Figure 3
Figure 3 Unclustered heatmap of differentially expressed genes demonstrates global responses of 3D constructs after PEMF exposure (≥2.5-fold change;
p value < 0.05).
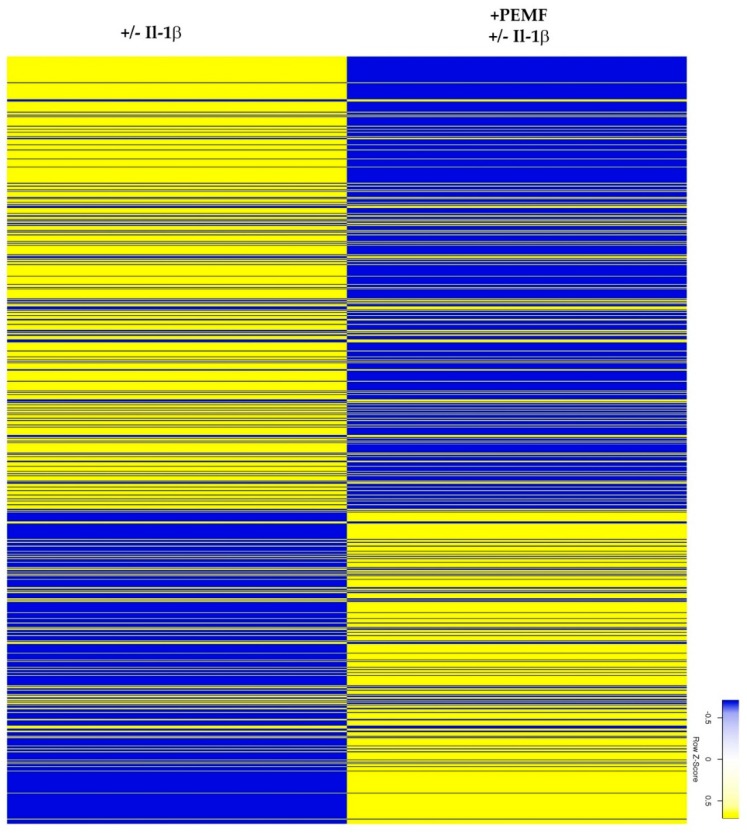 Figure 4
Figure 4 Heatmaps summarizing the differential expression of genes associated (
A) with GO term “extracellular matrix organization” and (
B) genes assigned to the GO term “collagen fibril organization” (≥2.0 fold change;
p value < 0.05).
 Figure 5
Figure 5 Heatmap of differentially expressed genes identified for the 2 paired groups ([−/+ Il-1β] and [+PEMF −/+ Il-1β]) assigned to the GO term “negative regulation of apoptotic process” (≥2.0 fold change;
p value < 0.05).
 Figure 6
Figure 6 Quantitative VENN diagram showing overlap of genes derived from differential expression analysis. Commonly regulated genes (≥2.0 fold change) are partially shown in the boxes. 3 of these genes were significantly up-regulated, whereas 39 genes were identified to be down-regulated (top 5 shown).
 Figure 7
Figure 7 Extracellular matrix organization in tendon-like constructs before and after Il-1β and/or PEMF treatment. (
A) Polarization microscopic images, phalloidin staining, and nuclear stain (DAPI) of 3D tendon constructs. (
B) Relative birefringence intensities as surrogate for collagen fiber organization (
n = 4). (
C) Actin stress fiber angle and nuclear angle dispersion determined for the 4 treatment groups (
n = 4). (
D) The expression of extracellular matrix genes
Col1a1,
Col1a2,
Col3a1 and
Col9a3 is shows up-regulation PEMF treatment in pro-inflammatory stimulated (+PEMF +Il-1β) samples although not statistically significant (
n = 9). (
E) Under pro-inflammatory conditions the matrix metalloproteinases-1, -2, -3, -9, -11 and -13 show no significant changes in their expression after PEMF treatment (
n = 7). (
F) Relative MMP2 and MMP9 activity in Il-1β-stimulated constructs with and without PEMF exposure (
n = 10). (
G) Expression of tendon related marker genes Scleraxis (Scx), Tenomodulin (Tnmd), and Mohawk (Mkx) is restored after PEMF treatment of pro-inflammatory primed tendon constructs (
n = 6).
 Figure 8
Figure 8 mRNA expression of cytoprotective cytokines. (
A) Gene expression of Il1r2 was significantly up-regulated after PEMF treatment, and some members of potentially cytoprotective cytokines of the Il-6/gp130 family also show an increase by trend (
n = 9) (
B) Il-6 cytokine levels were also elevated in culture supernatants PEMF-treated constructs as evidenced by ELISA analysis (
n = 5). (Lif leukemia inhibitory factor, Csf3 colony-stimulating factor 3). *
p < 0.05.
 Figure 9
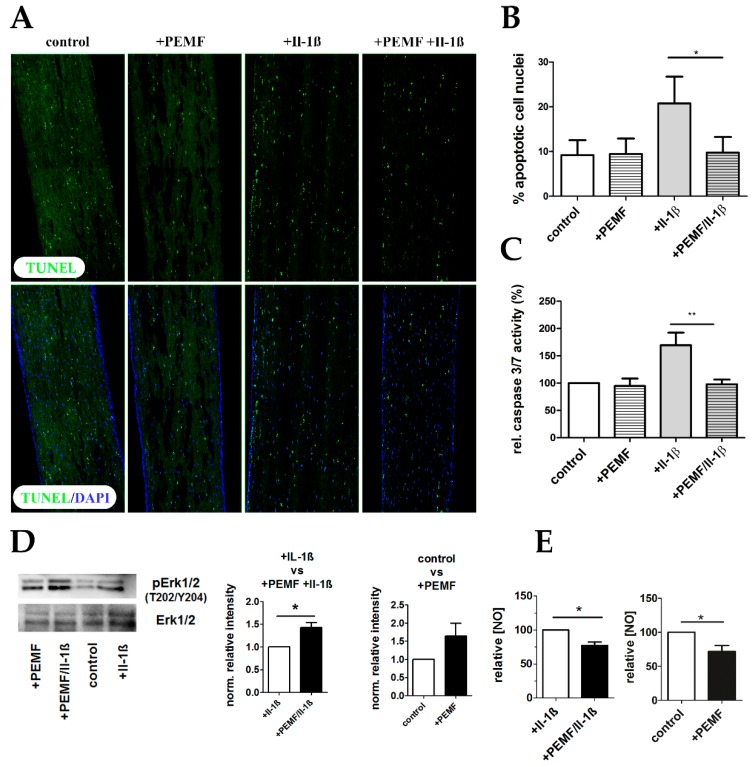
Figure 9 PEMF treatment attenuates apoptosis in pro-inflammatory stimulated tendon-like constructs. (
A) TUNEL Assay was performed to visualize apoptotic cell nuclei (green) showing the characteristic fragmented phenotype. (
B) Percent apoptotic cell nuclei was determined, demonstrating an anti-apoptotic effect of PEMF exposure of Il-1β-primed 3D constructs. (
C) Caspase3/7 enzyme activity was determined in protein lysates of tendon-like constructs of all for treatment groups, confirming that PEMF treatment significantly decreases apoptosis in pro-inflammatory stimulated samples. (
D) Representative Western blot and densitometric analysis (
n = 4) for phosphoERK1/2 and totalERK1/2 demonstrate activation of ERK1/2 after PEMF exposure. (
E) Total NO concentration is significantly reduced in cell culture supernatants of +PEMF +Il-1β and +PEMF treated tendon like constructs (
n = 5). *
p < 0.05, **
p < 0.01.